Terminología
|
|
Unidad
de transcripción
|
Los genes/cistrones/ORF que se transcriben bajo en control
de un mismo promotor
|
Promotor
|
Secuencia reconocida específicamente por la RNA polimerasa
para iniciar la transcripción de una unidad de transcripción.
|
Cistrón
|
Cada una de las partes de un transcrito que darán una
biomolécula funcional (proteína o RNA). En el caso de las proteínas, coincide
con un marco abierto de lectura (ORF).
|
Terminador
|
Conjunto de secuencias que marcan el fin de la transcripción
de una unidad de transcripción.
|
Operón
|
La unidad de transcripción (promotor, cistrones y
terminador) junto con las secuencias/genes adicinales que sirven para
regularlo.
|
Polaridad
|
Es el efecto de una mutación en un gen sobre la expresión
de otros cistrones distales dentro del mismo operón
|
Proteína
reguladora
|
Aquella que controlará la expresión de un operón. Pueden
ser activadoras o represoras.
|
Operador
|
Secuencia del promotor que es reconocida por una proteína
reguladora.
|
Efector
|
Biomolécula no proteica que controla la activación o
inactivación de la proteína reguladora. Las hay inhibidoras y
(co-)represoras.
|
Regulón
|
Conjunto de genes/operones que responden al unísono por la
acción de un regulador. Por ejemplo los regulones de choque térmico,
represión catabólica, o respuesta SOS.
|
Regulación en procariotas
Entre los organismos procariotas como las bacterias cuyo genoma es muy pequeño los genes se organizan en forma de operones como se describió en la historia de la genética. Es decir que varios genes involucrados en la misma ruta metabólica se transcriben juntos y sn controlados por el mismo promotor y la regulación del mismo.
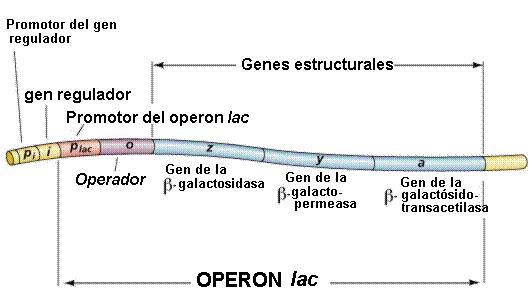
El operón con el que se ejemplifica esto es el Operón lactosa que posee dos tipos de control de su expresión. El control negativo y positivo.
Un esquema del operón lactosa se muestra en la siguiente imágen
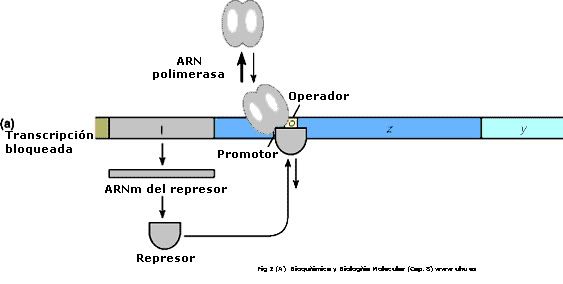
El control negativo se debe a que la proteina que regula al promotor impidiendo la transcripción es una proteína represora.

En el caso del control positivo es una proteína reguladora positiva la que controla al sistema. Es una proteína que se une al AMPc que aumenta ante la baja de glucosa en el medio y aumenta la tasa de transcripción
Regulación en Eucariotas
En este caso la regulación de los genes es mucho más compleja y depende de varios eventos:
- Regulación dada por las secuencias del ADN: En este caso el ADN posee muchas secuencias regulatorias o elementos de respuesta o secuencias internas de un promotor, algunas dentro del mismo promotor de un gen que son reconocidas por los factores de transcripción y por proteínas reguladoras aumentando la tasa de transcripción. En otros casos existen además los Aumentadores o Enhancers que cuando son reconocidos por una proteína reguladora aumentan aún más la tasa de transcripcióny no necesariamente están corriente arriba del gen sino que pueden localizarse dowstream o dentro del mismo gen. Asimismo existen silenciadores o silencers que cuando son reconocidos por una proteína específica bajan la tasa de trasncripción de un gen.
- En otros casos la misma estructura que adopta el ADN regula la expresión: El DNA puede adoptar la estructura clásica descripta por Watson y Crick (DNA tipo B) que es el que es activo a nivel de la transcripción. Esto es debido a que las proteínas reguladoras se unen a los surcos mayores del ADN. El ADN tipo B tiene surcos mayores y menores. En cambio el ADN tipo Z por su eje en forma de Zig zag no tiene ni surcos mayores ni menores por lo tanto las proteinas reguladoras no pueden unirse y por lo tanto aquellas regiones de ADN que adopten topologíaZ no serán transcriptas.
- La organización de la cromatina juega otro papel sumamente importante a nivel de la regulación: Comenzando por el hecho que la fibra de 30 nm o solenoide no es contínua sino que poseen regiones libres de nucleosomas que se denomina elementos reguladores del Locus y que dejan acceso a las proteínas reguladoras a las secuencias específicas para que puedan unirse y estimular la transcripción de un determinado gen en un determinado tejido. Estos patrones de la cromatina son propios de cada tejido dependiendo de que genes se requieren activos.A su vez hay cambios de las histonas que favorecen o frenas la expresión facilitando su afinidad con el ADN o reduciendola y de esta manera favoreciendo la transcripción y/o delimitándola.
- Por otra parte para evitar que las regiones de ADN menos condensadas en las células (fibra de 30 nm) continúen empaquetándose y terminen convertidas en heterocromatina impidiendo que ningún gen se exprese, existen unos elementos denominados Delimitadores o Insulatorsque impedirán como si fueran paredes que avance la heterocromatinización hacia regiones que deben transcribirse.
Finalmente tenemos otro tipo de regulación denominado IMPRINTING o sellado de una region de ADN o de genes que modifica la herencia de los genes tal como la describió Mendel, ya que es el sellado o silenciamiento de una region gracias a la metilación del ADN que es propia de si el cromosoma es de orígen materno o paterno. Por eso se dice que estos genes tienen expresión materna (cuando el gen sellado es el paterno) o paterna si el gen sellado es el materno es decir el que heredamos de nuestra madre. A su vez este tipo de sellado se vuelve a heredar a los hijos para que el gen continúe teniendo un sello materno o paterno. Muchos genes involucrados en el desarrollo embrionario tienen este tipo de sellado, asi como algunos involucrados en ciertas patologías como el cáncer.
Control de la Expresión Génica en Procariotas
En las bacterias, los genes son agrupadas en operons: grupos de genes que codifican las proteínas necesarias para llevar a cabo la coordinación función, tales como la biosíntesis de un determinado aminoácido. ARN que se transcribe a partir de procarióticas operons es polycistronic un término que implica que varias proteínas están codificados en un solo transcripción.
En bacterias, el control de la tasa de iniciación transcripcional es la predominante sitio para el control de la expresión génica. Al igual que ocurre con la mayoría de los genes procarióticas, apertura está controlada por dos elementos de la secuencia del ADN que son aproximadamente 35 bases y 10 bases, respectivamente, río arriba del sitio de transcripción inicio y, como tales, son identificados como los –35 y –10 posiciones. Estos 2 secuencia de elementos que se denominan promotor secuencias, porque promover el reconocimiento de la transcripción empezar por sitios de la ARN polimerasa. La secuencia de consenso para la posición –35 TTGACA, y para la posición –10, TATAAT. (La posición –10 es también conocido como Pribnow la caja.) Estas promotor secuencias son reconocidos y en contacto con la ARN polimerasa.
El actividad de la ARN polimerasa en un determinado promotor a su vez es regulada por interacción con las proteínas accesorias, que afectan a su capacidad para reconocer iniciar sitios. Estas proteínas reguladoras pueden actuar positivamente tanto (activadores) y negativamente (represores). El promotor de la accesibilidad procarióticas regiones de ADN es, en muchos casos, regulado por la interacción de con secuencias de proteínas denominados operadores. El operador es la región adyacente al promotor en la mayoría de los elementos y en operons la mayoría de los casos las secuencias del operador obligar a una proteína represora. Sin embargo, hay varios en operons E. coli que contienen la superposición de secuencia elementos, uno que se une un represor y una que se une un activador.
Ya que se ha indicado anteriormente, procarióticas genes que codifican las proteínas necesarias para realizar la función coordinada se agrupan en operons. Dos de los principales modos de función de regulación transcripcional en bacterias (E. coli) para controlar la operons de expresión. Ambos mecanismos de participación de las proteínas represor. Un modo de regulación se ejerce a operons de genes que producen productos necesarios para la utilización de la energía, que son reguladas catabolite operons. El otro modo operons regula los genes que producen productos necesarios para la síntesis de pequeñas biomoléculas, como aminoácidos. Expresión de esta última clase de operons es atenuado por las secuencias en el ARN transcrito.
Un ejemplo clásico de un catabolite operón regulado es la lac operón, responsable para la obtención de energía a partir de β-galactósidos tales como la lactosa. Un ejemplo clásico de un operón atenuada es la trp operón, responsable de la biosíntesis de triptófano.
The lac Operon
El yac operón (véase el diagrama que figura a continuación) consiste en un gen regulador (el i de genes) y tres genes estructurales (z, y, y a). El i gen codifica para el represor de la lac operón. El z gen codifica para la β-galactosidasa (β-gal), que es el principal responsable de la hidrólisis de la disacárido, lactosa en sus unidades monoméricas, galactosa y glucosa. El y gen codifica para permease, lo que aumenta permeabilidad de a la célula β-galactósidos. El a gen codifica una transacetylase. En condiciones normales de crecimiento en un de glucosa a base de medianas, el lac represor está obligado a la región de operador de la lac operón, la prevención de la transcripción. Sin embargo, en la presencia de un inductor de la lac operón, la proteína represora se une el inductor y se ve incapaz de interactuar con el operador de la región operón. ARN polimerasa es capaz de obligar a los promotores en la región, y transcripción de la operón ensues. El lac operón está reprimida, incluso en la presencia de lactosa, glucosa, si también está presente. Esta represión es mantenerse hasta que el suministro de glucosa se ha agotado. La represión de la lac operón en estas condiciones se denomina catabolite represión y es el resultado de los bajos niveles de cAMP que el resultado de un suministro adecuado de glucosa. La represión de la lac operón es relevado en la presencia de glucosa en caso de exceso de cAMP se añade. Como el nivel de de glucosa en el medio caídas, el nivel de aumentos de cAMP. Al mismo tiempo existe es un aumento en el inductor vinculante a la lacrepresor. El resultado neto es un aumento en la transcripción del operón. La capacidad del campamento para activar la expresión de la lac operón los resultados de una interacción de campamento con una proteína denominada PCR (de la proteína del receptor de cAMP). La proteína también se denomina PAC (catabolite activador de la proteína). El campamento-CRP complejo se une a una región de la lac operón justo arriba de la región obligados por la ARN polimerasa y que algo que se superpone la de represor sitio de unión de la región operador. La unión de la cAMP-CRP a la compleja lac operón estimula la actividad de la ARN polimerasa 20-a-50-veces.

Reglamento de la lac en el operón E. coli. El represor de la operón se sintetiza a partir de la i de genes. El proteína represora se une al operador de la región operón e impide que el ARN la polimerasa de transcribir el operón. En presencia de un inductor (por ejemplo como el inductor natural, allolactose), el represor es inactivado por interacción con el inductor. Esto permite que la ARN polimerasa de acceso a la operón y transcripción producto. El resultado ARNm codifica la β-galactosidasa, permease y transacetylase actividades necesarias para la utilización de β-galactósidos (como la lactosa) como fuente de energía. El lac es, además, operón regulados a través de la unión de cAMP receptor-proteína, CRP (también denominado el catabolite activador de la proteína, PAC) a las secuencias de cerca de la de promotor de dominio el operón. El resultado es una mejora 50 veces la actividad de la polimerasa.
The trp Operon
El trp operón (véase diagrama siguiente) codifica los genes para la síntesis de triptófano. Este grupo de los genes, al igual que el lac operón, está regulado por un represor que se une a el operador de secuencias. La actividad de la trp para el represor vinculante operador de la región es mayor cuando se une a triptofano, y en esta capacidad, triptófano que se conoce como un corepressor. Desde la actividad de la trp represor es mayor en presencia de triptófano, la tasa de expresión de la trp operón está clasificado en respuesta al nivel de triptófano en la celda.
Expresión de la trp operón también está regulado por la atenuación. El atenuador región, que se compone de secuencias encuentran en el ARN transcrito, es implicadas en el control de la transcripción de la operón después de la ARN polimerasa ha iniciado la síntesis. El atenuador de las secuencias de ARN se encuentran cerca de la 5 'final de la ARN llamado el líder de la región de ARN. El líder secuencias son situada antes del inicio de la codificación de región para el primer gen de la operón (el trpE de genes). El atenuador región contiene uno de los codones polipéptido pequeño líder, que contiene triptófano tándem codones. Esta región de la ARN también es capaz de formar varios estable tallo-bucle estructuras.
Dependiendo del nivel de triptófano en la celda y, por ende, el nivel de cargado trp-ARNt, el posición de los ribosomas en el líder del polipéptido y la rapidez con que se permite la traducción de diferentes bucles de tallo-de forma. Si el triptófano es abundante, la ribosoma impide que se derivan de circuito 1-2 de la formación y, por tanto, favorece tallo-bucle 3-4. Este último se encuentra cerca de una región rica en uracil y actúa como el transcripcional de terminación bucle tal como se describe en la la síntesis de ARN. En consecuencia, la ARN polimerasa es desplazado de la plantilla.
El operons codificación de los genes necesarios para la síntesis de una serie de otros aminoácidos también son regulados por la presente mecanismo de atenuación. Debe quedar claro, sin embargo, que este tipo de regulación transcripcional no es viable para las células eucariotas.

Reglamento de la trp operón en E. coli. El trp operón está controlada por un proteína represora vinculante para el operador región, así como por la traducción inducida transcripcional de atenuación. El PRT represor se une al operador de la región el trp operón sólo cuando la obligación de triptófano. Esto hace que el triptófano un co-represor de la operón. El trpL codifica un gen no funcional líder péptido que contiene varias adyacentes trp codones. El tructural de los genes responsables de operón triptófano biosíntesis son trpE, D, C, B y A. Cuando se trptophan nivel alto algunos se une al represor, que luego se une a la región y el operador inhibe la transcripción. El mecanismo de atenuación de la trp operón está diagramado a continuación.
Atenuación de la trp operón. La atenuación de la región trp operón contiene secuencias que permiten que el ARNm resultante para formar diferentes tallo-bucle estructuras. Estas regiones se identifican como del 1 al 4. El tallo-que son los bucles significativo en cuanto a si la transcripción es atenuada o no se forman entre las regiones 2 y 3 o entre las regiones 3 y 4. Cuando los niveles de triptófano son altos hay mucho cargado trp-ARNt disponibles y ribosomas traducir el líder péptido codificado por el trpL de genes no estancar en las reiteradas trp codones en el péptido líder. En estas condiciones, la ribosomas cubrir rápidamente las regiones 1 y 2 del ARNm que permite la tallo-bucle compuesto de las regiones 3 y 4 de forma. El tallo-bucle formado por regiones 3-4 resultados en una estructura de terminación transcripcional y transcripción de la trp deja operón, es decir, se atenúa. Por el contrario, cuando los niveles de triptófano son bajos el nivel de cargado trp-ARNt también será baja. Esto lleva a un estancamiento de los ribosomas en el líder péptido que se enfrentan cuando el PRT codón repite. El ribosoma puestos más región 1 del ARNm que permite el paso en bucle 2-3 a la forma y evita que el transcripcional terminación tallo-bucle de la formación de 3-4. La incapacidad de este estructura de forma permite a todo el operón para su transcripción y la triptófano biosynthetic enzimas que se producen.
Control de Genes en Eucariotas
En células eucarióticas, la habilidad para expresar las proteínas biológicamente activas en virtud de la regla viene a varios puntos:
1.Estructura de la Cromatina: La estructura física del ADN, tal como existe compactada en cromatina, pueden afectar a la capacidad de regulador transcripcional de proteínas (lo que se denomina factores de transcripción) y ARN polimerasas para encontrar el acceso a determinados genes y para activar la transcripción de ellos. La presencia de modificaciones de las histonas y CPG de metilación más afectan a la accesibilidad de la cromatina a ARN polimerasas y factores de transcripción.
2. Epigenéticos de Control: Epigénesis se refiere a cambios en el patrón de expresión de genes que no se deben a los cambios en el composición de nucleótidos del genoma. Literalmente "epi" significa "en" por lo tanto, epigenética significa "sobre" el gen en contraposición a "por" el gen.
3. Transcripcional Iniciación: Este es el modo más importante para el control de la expresión de los genes eucariotas (véase a continuación para más detalles). Factores específicos que ejercen el control de incluir la fuerza de los elementos promotor dentro de la secuencias de ADN de un gen, la presencia o ausencia de secuencias potenciador (que aumentan la actividad de la ARN polimerasa en una dado por el promotor vinculante factores de transcripción específicos), y la interacción entre múltiples activador inhibidor de las proteínas y las proteínas.
4. Transcripción de Procesamiento Modificación y: ARNm eucarióticos debe ser limitado y polyadenylated, y los intrones deben ser eliminados con precisión (véase la síntesis de ARN Page). Varios genes han sido identificado que se someten los tejidos-patrones específicos de splicing alternativo, que generar proteínas biológicamente diferentes del mismo gen.
5. Transporte de ARN: Un procesado totalmente ARNm debe abandonar el núcleo en para ser traducido a proteína.
6. Transcripción de Estabilidad: A diferencia de ARNm procarióticas, cuyas vidas medias son todos en el rango de 1 a 5 minutos, ARNm eucarióticos puede variar mucho en sus estabilidad. Algunos han inestable transcripciones secuencias (predominantemente, pero no exclusivamente, en el 3'-no traducido regiones) que son señales de una rápida degradación.
7. Traslacional Iniciación: Dado que muchos ARNm tiene múltiples codones metionina, la capacidad de los ribosomas para reconocer y poner en marcha a partir de la síntesis correcta puede codón AUG afectan a la expresión de un gen producto. Varios ejemplos han surgido lo que demuestra que algunas proteínas eucariotas iniciar en no-AUG codones. Esto fenómeno se ha conocido que se produzca en E. coli durante bastante tiempo, pero sólo recientemente se ha observado en ARNm eucarióticos.
8. Pequeños ARN y el Control de los Niveles de Transcripción: En los últimos años un nuevo modelo de regulación génica ha surgido que implica el control ejercido por los pequeños no codificante ARN. Este pequeño ARN-mediado de control puede ser ejercido ya sea en el nivel de la traducibilidad de los ARNm, la estabilidad del ARNm oa través de cambios en la estructura de la cromatina.
9. Post-traslacional Modificación:Común modificaciones incluyen glicosilación, acetilación, acilación grasos, disulfuro de formaciones de bonos, etc
10. Proteínas de Transporte: Con el fin de que las proteínas a ser biológicamente activas después de la traducción y transformación, que deben ser transportados a su lugar de acción.
11. Control de la Estabilidad de Proteínas: Muchas proteínas son rápidamente degradadas, mientras que otros son muy estables. Específicas secuencias de aminoácidos en algunas proteínas se ha demostrado para lograr la rápida degradación.
Estructura de la Cromatina y el Control de la Expresión Génica
En un amplio examen de la estructura de la cromatina hay dos formas: heterocromatina y euchromatin que originalmente fueron designados sobre la base de citológico observaciones de la forma oscura las dos regiones fueron teñidos. Heterocromatina es más densamente euchromatin y que se encuentra a menudo cerca de los centrómeros de los cromosomas. Heterocromatina es en general transcriptionally silencio. Euchromatin por otra parte, es poco más embalados y es que activa la transcripción de genes que se encuentran a estar tomando lugar.
Si bien es posible predecir transcriptionally activa de las regiones cromatina sobre la base de ensayos citológicos, la investigación en los últimos decenios han comenzado a definir las bases moleculares para la estructura de la cromatina en el contexto de regulación de la expresión génica. Dos primaria existen mecanismos que modifican la cromatina estructura, y como consecuencia de alteraciones en el efecto de la expresión génica. Estos mecanismos de metilación de citidina residuos en el ADN que se encuentran en la dinucleótido, CG (la mayoría de las veces escrito como un dinucleótido CpG) y la histona modificación. Metilación como un modificación del ADN se abordó en la ADN Metabolismo Página, sin embargo, aquí se debate ampliar para definir cómo esta modificación altera el patrón de expresión génica.
Al determinar que los residuos C en el ADN son objetivos de metilación se descubrió que más de un 90% de metil-C se encuentra en el dinucleótido, CpG. Esto no quiere decir que todos los CpG dinucleotides contener una metilado C de residuos. Al examinar la estructura de los genes eucariotas y la identificación de las regiones del CpG dinucleotides es el caso de que el promotor de las regiones contienen genes 10-20 como muchas veces CpGs en comparación con el resto del genoma. En un sentido general lo que se conoce acerca de metilación del ADN y la transcripción es la condición de que cuando regiones de un gen que puede ser metilado son, el gen se asocia transcriptionally en silencio y cuando la región está en el gen metilado se transcriptionally activa o se puede activar. Al someterse a la diferenciación de las células se ha observado que los genes que se activan transcriptionally exposición una reducción en la metilación estado en relación con el nivel previo a la activación y en virtud de que esta metilación-sigue siendo incluso después de la transcripción cesa. El papel de Metilación del ADN en el control de la actividad transcriptionally demostrado por primera vez por el tratamiento de las células en la cultura con la citidina analógico, 5-azacytidine (5-azaC) que tiene un nitrógeno en la posición 5 del anillo de pirimidina en lugar de uno de carbono y, por tanto, no puede servir como un sustrato para la metilación. Cuando los fibroblastos se cultivadas en la presencia de 5-azaC que diferenciada en Mioblastos. Esto diferenciación ha demostrado ser el resultado de los menores de metilación y la activación de la MyoD gen (un regulador maestro de la diferenciación muscular).
La metilación del ADN es la catalizada por las diferentes ADN methyltransferases (abreviado Dnmt). La función crítica de la metilación del ADN en controlar el desarrollo destinos se demostró en ratones ya sea por inactivar Dnmt3a o Dnmt3b. Pérdida de genes, ya sea causado la muerte poco después del nacimiento. Cuando las células dividen el ADN contiene un capítulo de los padres del ADN y un capítulo de el recién replicado el ADN (la hija del capítulo). Si contiene el ADN metilado cytidines CpG dinucleotides en el capítulo hija debe someterse a la metilación en para mantener el patrón de los padres de la metilación. Este "mantenimiento" metilación es la catalizada por Dnmt1 y, por lo tanto, esta enzima se llama el methylase mantenimiento.
La correlación entre la metilación del ADN y la estructura de la cromatina en lo que se refiere a la actividad transcripcional se demuestra por la observación de que hay varias proteínas que se unen a metilado CpGs pero no a unmethylated CpGs. Uno tales proteínas se MeCP2 (metacrilato CP de proteína de unión 2). Cuando se une a MeCP2 metilado CPG dinucleotides la toma de ADN en la cromatina una estructura cerrada y conduce a la represión transcripcional. La capacidad de MeCP2 de obligar a metilado CpGs a su vez es controlada por su estado de fosforilación. Cuando se MeCP2 fosforilados que se une con menos afinidad al ADN y adquiere una mayor apertura cromatina estado. La importancia de MeCP2 la cromatina en la regulación de la estructura y por consiguiente, la transcripción se demuestra por el hecho de que las deficiencias en este proteínas en el resultado síndrome de Rett. El síndrome de Rett es un desarrollo neurológico trastorno que se produce casi exclusivamente en las mujeres se manifiesta como mental retraso, convulsiones, microcefalia, arrestado el desarrollo, y la pérdida de expresión.
Como se describe en el ADN Metabolismo Página, las proteínas histonas son un tema serie de modificaciones y esas modificaciones se sabe que afectan a la estructura de la cromatina. Acetilación de histonas es sabido que da lugar a una mayor apertura estructura de la cromatina y modificar estas histonas se encuentran en las regiones de la la cromatina que se transcriptionally activa. Por el contrario, de underacetylation histonas se asocia con el cierre de la cromatina y la inactividad transcripcional. Un correlación directa entre la acetilación de histonas y la actividad transcripcional demostrada cuando se descubrió que los complejos de proteínas, anteriormente conocido por transcripcional ser activadores, se determinó que la histona acetylase actividad. Y como era de esperar, represor transcripcional complejos eran contener la histona deacetilasa actividad. Vínculo entre la metilación del ADN y silenciamiento transcripcional se ha demostrado que la observación de que las proteínas que se unen a metil CpG dinucleotides puede contratar a deacetylases histonas del ADN. Las proteínas se sabe que interactúan con acetilado lysines en las histonas que juntos conducen a una más estructura de la cromatina abierta. Proteínas que se unen a las histonas contienen acetilado un dominio llamado bromodomain. El bromodomain se compone de un conjunto de cuatro hélices α-y es un dominio de proteínas que participan en las interacciones proteína-en una número de sistemas celulares, además de la histona acetilado vinculante y estructura de la cromatina modificación.
Otra modificación de las histonas sabe que afectan a la estructura es la cromatina metilación. Sin embargo, con la metilación de histonas no hay una correlación directa entre la modificación y un efecto específico sobre la transcripción. La metilación de la histona H4 en R4 (arginina en la posición 4) promueve un abierto la cromatina estructura y, por lo tanto, conduce a la activación transcripcional. Metilación de histona H3 en K4 y K79 (lysines 4 y 79) se ha demostrado que actuar al igual que histona H4 R4 metilación. Sin embargo, la metilación de las histonas H3 en K9 y K27 es que están asociados con genes inactivos transcriptionally. La metilación de histonas proporciona un sitio para la unión de otras proteínas que a su vez conduce a alteración de la estructura de la cromatina a un estado más compactada. Proteínas que se unen lysines a metilado presente en las histonas (así como otras proteínas) contienen un dominio llamado chromodomain. El chromodomain consta de un tramo conservado de 40-50 aminoácidos y se encuentra en muchos proteínas implicadas en la remodelación de la cromatina complejos. Además, chromodomain las proteínas se encuentran en el ARN-transcripcional inducidos por silenciar (RITS) complejo implica que los pequeños ARN de interferencia (siARN) y microARN (miARN)-medicamentosos downregulation de transcripción (véase el por debajo de).
Proteínas histonas también puede ser modificado por la adición de pequeñas proteínas ubiquitina. Con respecto a las histonas, uiquitin se encuentra sólo en las histonas H2A y H2B y sólo un pequeño porcentaje de las histonas H2A se encuentra ubiquitinated. Sin embargo, cuando ubiquitinated, H2A está relacionado con la represión de la transcripción. El lugar exacto de efecto contrario se observa cuando la histona H2B es ubiquitinated, lo que lleva a una estimulación de la actividad de genes. La razón por la que ubiquitinated histonas H2B es relacionados con la actividad transcripcional es que esta modificación promueve la metilación de las histonas H3 en K4 y K79, que como se ha indicado anteriormente se asocia con estructura de la cromatina abierta.
Fosforilación de las histonas se produce principalmente en respuesta a las señales de fuera de tales como la estimulación del factor de crecimiento o inductores de estrés, tales como golpes de calor. Fosforilados histonas están localizados a los genes que se convierten en transcriptionally activa como consecuencia de estas señales fuera. La importancia de la histona fosforilación en el control de la expresión génica puede ser demostrado en pacientes Coffin-Lowry, síndrome de. Esta enfermedad se debe a defectos en la RSK2 gen que codifica la histona phosphorylating enzima. Síndrome de Coffin-Lowry es una rara forma de X-mental ligado se caracteriza por retraso malformaciones esqueléticas, retraso del crecimiento, la audición déficit, los trastornos del movimiento paroxístico, y el deterioro cognitivo en las zonas afectadas hombres.
Epigenéticos de Control de la Expresión Génica
El término epigenética fue acuñado por Conrad Waddington en 1939 para definir el desarrollo de la genética durante el desarrollo del programa. Además, se acuñó epigenotype el término para definir "el desarrollo total del sistema vías de desarrollo interrelacionados a través de la cual la forma adulta de un organismo se realiza". Es evidente que esta definición abarca una amplia gama de conceptos se ocupan de la genética, la herencia y el desarrollo. Hoy en día el término epigenética se utiliza para definir el mecanismo mediante el cual los cambios en el patrón heredado de la expresión de los genes ocurren en la ausencia de alteraciones o cambios en los nucleótidos composición de un determinado gen. Una interpretación literal es que la epigenética media "Además de los cambios en la secuencia del genoma." La manera más fácil de entender este concepto es pensar en el óvulo fertilizado: en el momento de la fecundación que sola célula es totipotentes, es decir, que divide a la hija en última instancia, diferenciar las células en todas las diferentes células del organismo. La gúnica diferencia entre el diversas células del organismo resultante son las consecuencias de diferencial la expresión de los genes, y no debido a las diferencias en las secuencias de los genes sí mismos. Las pruebas indican que la mayoría de las modificaciones epigenéticas son borrarse durante la gametogénesis y / o después de la fertilización.
Varios tipos diferentes de eventos epigenéticos han sido identificados. Ya que se describe en la sección anterior relativa a la estructura de la cromatina como un medio para control de la expresión de los genes y el papel de la metilación del ADN en estos estructural cambios, metilación del ADN es probable que sea el más importante evento epigenéticos importante controlar y mantener el patrón de expresión génica durante desarrollo. Otros eventos de modificación de ADN también se conocen a efectos epigenéticos incluidos los fenómenos acetilación, metilación fosforilación, y ubiquitylation sumoylation de las proteínas histonas. Por lo tanto, debe quedar claro que los mismos hechos que afectan a la cromatina estructura puede definirse como eventos epigenéticos. Un adicionales proceso que afecta estructura de la cromatina y, por tanto, genes expresión es considerada un evento y epigenética se trata de los pequeños ARN de interferencia (siARN) se describen a continuación.
Considerando que, epigénesis desempeña un papel fundamental en la regulación, control y mantenimiento de la expresión de los genes que conduzcan a la diferenciación de muchos estados de las células de un organismo, las recientes pruebas ha identificado un vínculo entre la procesos epigenéticos y la enfermedad. Lo más importante es el vínculo entre epigénesis y el cáncer que se ha sugerido que un factor que contribuye a casi la mitad de todos los cánceres. Una clara demostración se ha realizado entre los cambios en el estado de metilación tumor supresor genes y el desarrollo de muchos tipos de cáncer. Efectos epigenéticos en función del sistema inmune también se han identificados. Además, hay indicios de un vínculo entre la epigenética los procesos y la salud mental.
Control de la Transcripción Eucariótica Inicio
Transcripción de las diferentes clases de ARN en eucariotas se lleva a cabo por tres polimerasas diferentes (véase el la síntesis de ARN). ARN pol I sintetiza la ARNr, a excepción de los 5S especies. ARN pol II sintetiza los ARNm y algunos ARN pequeños nucleares (ARNsn's) que trabajan en el empalme de ARN. ARN pol III sintetiza los 5SARNr y el ARNt. La gran mayoría de los ARN son eucariotas sometido a post-transcripcional de procesamiento.
El más complejo de control observado en eucariotas son los genes que regulan la expresión de ARN pol II-genes transcriben, el ARNm de genes. Casi todos los genes eucariotas ARNm contienen una estructura básica consistente de los exones de codificación y no de codificación de intrones y promotores basal de dos tipos y cualquier número de diferentes ámbitos de regulación transcripcional (véase diagramas de abajo). El promotor basal se denominan elementos CCAAT cajas y cajas de TATA-a causa de su secuencia de motivos. La caja de TATA reside 20 a 30 bases antes de iniciar la transcripción y el sitio es en secuencia similar a la procarióticas Pribnow caja (consenso TATAT/AAT/A, donde T/A indica que cualquiera de base puede encontrarse en que posición).

Estructura típica de un ARNm eucarióticas gen.
Numerosas proteínas identificadas como TFIIA, B, C, etc (por transcription factores que regulan ARN pol II), se han observado para interactuar con el TATA-box. La caja CCAAT (consenso GGT/CCAATCT) reside de 50 a 130 bases río arriba de la transcripción sitio web inicial. La proteína identificada como C/EBP [por CCAAT-box/Enhancer vinculante ("Binding") Proteínas] se une para CCAAT la caja de elemento.
Hay muchos otros aspectos de la normativa ARNm en secuencias genes, así como, que se unen diversos factores de transcripción (véase el diagrama que figura a continuación). Tesis secuencias reguladoras son predominantemente situadas aguas arriba (5') de la transcripción inicio del sitio, aunque algunos elementos se producen aguas abajo (3') o incluso dentro de los propios genes. El número y el tipo de elementos reguladores de se varía con cada gen ARNm. Diferentes combinaciones de transcripción factores que también pueden ejercer efectos diferenciales de regulación transcripcional a inicio. Los diversos tipos de células cada uno de combinaciones de expresar las características de factores de transcripción, lo que es el principal mecanismo de tipo de células en la especificidad la regulación de la expresión génica ARNm.

Estructura de la parte de arriba de una región típica eucariota gen ARNm que hipotéticamente contiene 2 exones y un único intrón. El diagrama indica la caja de TATA y CCAAT cuadro basal - elementos en las posiciones -25 y -100, respectivamente. El factor de transcripción TFIID ha demostrado ser la caja de TATA-proteína de unión, PDD. Varios adicional factor de transcripción vinculante los sitios han sido incluidos y se muestra a residir aguas arriba de los 2 elementos basal y de la transcripcional sitio web inicial. La ubicación y el orden de la diversas indicó factor de transcripción-unión es sólo de diagrama indicativo y no como típico de todos los genes eucariotas ARNm. Allí existe una amplia gama de diferentes factores de transcripción que regulan la transcripción de las 3 clases de eucariota gen que codifica la ARNm, ARNt y ARNr. [CREB = cAMP respuesta elemento vinculante de proteínas] [C/EBP = CCAAT-box/enhancer proteína de unión]. El gran círculo verde representa ARN polimerasa II.
Estructurales Motivos en factores de Transcripción Eucariótica
Homeodominio: El homeodominio es un dominio altamente conservado de 60 aminoácidos ácidos se encuentran en una gran familia de factores de transcripción. Esta familia es primero identificados en Drosophilacomo un grupo de genes que, cuando se modifiquen, se causa las transformaciones de una parte del cuerpo de otro (por ejemplo, las piernas de la antena), por lo que homeóticos llamado transformaciones. Esta clase de genes ha sido identificado en tanto de invertebrados y vertebrados organismos. El homeodominio sí mismo constituye una estructura muy similar a la bacteriana hélice-giro-hélice proteínas. El función principal de todas las proteínas que contienen homeodominio está en el establecimiento de un patrón en el organismo como el de la columna vertebral en vertebrados.
POU Dominio: El POU de dominio es un dominio que es un híbrido entre un dominio relacionado con el homeodominio POU y un dominio específico. El término POU se deriva de los nombres de los 3 primeros factores han demostrado que una región de similitud, Pit-1 (un pituitaria-factor de transcripción específico), Oct-1 (un octamer proteína de unión por primera vez de regular la transcripción de genes de inmunoglobulina) and unc-86 (un nematodo gen).
Hélice-Bucle-Hélice(HLH): La HLH dominio participa en la dimerización de proteínas. El motivo de HLH se compone de dos regiones de α-hélice separadas por una región de longitud variable que forma un bucle entre el 2 alpha espirales. Este motivo es bastante similar a la hélice-giro-hélice motivo de encontrarse en varios factores de transcripción procarióticas como la proteína CRP que participan en la regulación de la lac operón. La α-helicoidal dominios son estructuralmente similares y son necesarios para la interacción con la proteína secuencia de elementos que presentan un doble eje de simetría. Esta clase de factor de transcripción la mayoría de las veces contiene una región de aminoácidos básicos situado en la N-terminal del lado de la HLH de dominio (lo que se denomina bHLH proteínas) que se necesario para que la proteína de obligar a ADN en secuencias específicas. La ABA dominio es necesaria para homo-y heterodimerization. Ejemplos de proteínas bHLH incluir MyoD (myogenesis inducir un factor de transcripción) y MYC (originalmente identificado como un oncogén retroviral). HLH varias proteínas que no contengan la básica región de actuar como represores, porque de esta falta. Estas proteínas reprimir ABA la actividad de otras proteínas bHLH formando heterodimers con ellos y la prevención de ADN vinculante.
Dedos de Zinc: El dedo de zinc es un dominio de ADN vinculante motivo consistente específicas de spacings de la cisteína y la histidina residuos que permitan la proteína de obligar a los átomos de zinc. El átomo de metal coordina las secuencias de todo el cisteína y residuos de histidina en un dedo de la mano-como dominio. El dedo de la mano dominios puede interdigitate en los principales ranura de la hélice de ADN. El espaciamiento de los zinc dedo de la mano de dominio en esta clase de factor de transcripción coincide con un media vuelta de la doble hélice. El ejemplo clásico es el ARN pol III factor de transcripción, TFIIIA. Proteínas de los esteroides / hormona tiroidea de la familia factores de transcripción también contienen zinc dedos.
Leucina Cremallera: La leucina cremallera de dominio es necesaria para la proteína dimerización. Es un motivo generado por la repetición de una distribución de leucina 7 espaciados residuos de aminoácidos, aparte dentro de α-helicoidal regiones de la proteína. Estos residuos de leucina acabar con su R-grupos protuberantes de la α-helicoidal de dominio en el que la leucina residuos residen. El saliente R-grupos se cree que interdigitate R leucina con grupos de otra leucina cremallera de dominio, por lo tanto, la estabilización de homo - o heterodimerization. La leucina cremallera de dominio está presente en muchos de ADN obligatorio proteínas, tales como MYC, y C/EBP.
Hélice Alas: Las alas hélice de ADN es un motivo vinculante, compuesto de un α/β estructura. Esta estructura contiene 3 N-terminal de α-hélices y un 3-hundidos antiparallel β-hoja. El plegado de la hoja de β-región acerca de la α-hélices dar la apariencia de alas en las espirales, por lo tanto, el término alas-hélice. Este motivo se identificó por primera vez en el factor de transcripción HNF-3γ. Es un HNF-3γ miembro de una gran familia de factores de transcripción que están relacionadas con la Drosophila forkhead genes, de ahí la familia de genes que se denomina la horquilla cabeza (FKH) familia. La nomenclatura de la horquilla cabeza de familia de factores de transcripción ha se modificó a fin de que todos los miembros tienen nombres que inician con Fox.
Cuadro Representante de Factores de Transcripción
| Factor | Secuencia Motif | Comentarios |
| MYC y MAX | CACGTG | MYC identificó por primera vez como oncogén retroviral; específicamente MAX se asocia con MYC en las células |
| FOS y JUN | TGAC/GTC/AA | tanto de primer como oncogenes retrovirales; asociados en las celdas, también conocido como el factor AP-1 |
| CREB | TGACGC/TC/AG/A | se une al elemento de respuesta cAMP (CRE), la familia de al menos 10 factores resultantes de los distintos genes o splicing alternativo; pueden formar dímeros con JUN |
| ERBA; también TR (los receptores de la hormona tiroidea) | GTGTCAAAGGTCA | identificó por primera vez como oncogén retroviral; miembro de la esteroide / tiroides superfamilia de receptores hormonales, se une la hormona tiroidea |
| ETS | G/CA/CGGAA/TGT/C | identificó por primera vez como oncogén retroviral; predomina en B- y células T- |
| GATA | T/AGATA | la familia de las células progenitoras eritroides específico de las células factores, GATA-1 a -6 |
| MYB | T/CAACG/TG | identificó por primera vez como oncogén retroviral; hematopoyética específico de las células factor |
| MYOD | CAACTGAC | maestro de control de la diferenciación de células musculares |
| NFκB y REL | GGGAA/CTNT/CCC(1) | ambos factores identificados independiente; REL identificó por primera vez como oncogén retroviral; predominan en B y células T |
| RAR (ácido retinoico receptor) | ACGTCATGACCT | se une a elementos denominado RAREs (ácido retinoico los elementos de reacción) también se une a JUN/FOS sitio |
| SRF (suero factor de respuesta) | GGATGTCCATATTAGGACATCT | existe en muchos genes que son inducibles por la presente los factores de crecimiento en el suero |
La lista es sólo representante de los cientos de identificados factores, algunos se hace hincapié en varios factores que muestran oncogénico potencial.
(1) N significa que cualquier base puede ocupar esa posición.
Pequeños ARN y Después de la Regulación Transcripcional
En fecha tan reciente como hace 15 años se creía que la gúnica no-codificación ARN fueron los ARNt y el ARNr de la traslacional maquinaria. Sin embargo, en un estudio publicado en 1993 sobre el control de desarrollo en el calendario roundworm Caenorhabditis elegans se demostró que el control de un gen fue ejercida por los pequeños no codificantes de ARN producto de otro gen. Esto gen regulador se identifica como lin-4 (lin-4 controla la actividad de la lin-14 producto de genes) y códigos de dos ARN, es un aproximadamente 22 nucleótidos (nt) y la otra es de aproximadamente 61 nt. Examen de la secuencias de las más grandes de ARN reveló que podría constituir un tallo-bucle estructura que luego sirve como precursor para la corta de ARN. El más corto lin-4 ARN es considerado el miembro fundador de la clase de reglamentación de los pequeños ARN llamados microARN o miARN que consisten de aproximadamente 22 nt. Es predijo que al menos 250 miARN genes están presentes en el genoma humano.
El tratamiento y el funcionamiento de miARN es similar a la del ARN silenciamiento vía identificados en las plantas conocido como el gen posttranscriptional silenciamiento (PTGS) y la vía de inhibitoria ARN (ARNi) en vía de los mamíferos. El ARNi vía implica la transformación enzimática de la doble-hundidos en los pequeños ARN ARN de interferencia (siARN), de aproximadamente 22–25 nt que puede haber evolucionado como una medios para degradar el ARN de genomas de ARN del virus, como retrovirus. El vía de tramitación de ambos miARN y siARN en diagramado en la figura a continuación. El tallo-bucle de la primaria miARN transcripción de genes (pri-miARN) es la primera escindida a través de la acción de la RNasa III relacionados con la actividad denominada Drosha que tiene lugar en el núcleo y genera el precursor miARN (pre-miARN). En la vía de la siARN dúplex ARN son escindida en 22–25 nt piezas a través de la acción de la enzima Dicer en el citosol. Transformados miARN tallo-bucle de estructuras son transportados desde el núcleo a través de la concentración citosólica de la actividad de exportin5. En el citosol el miARN procesadas tallo-bucle está dirigido por Dicer que elimina parte del bucle. La nomenclatura de la madurez es miARN duplex miARN:miARN*, cuando el miARN* capítulo es la no-funcional la mitad de los duplex. En última instancia, completamente transformados miARN y siARN sean contratados por el inducido por ARN silenciador complejo (RISC) que separa las dos vertientes del ARN. El capítulo de activos derivados de ARN a partir de las miARN o siARN es la vía anti-sentido a una región de la meta ARNm.

Modelo para la transformación miARN y siARN
Existen dos modelos para saber cómo siARN y miARN interferir con la expresión de genes objetivo. Estos modelos incluyen dirigido degradación de la meta o ARNm interferencia con la traducción de un ARNm objetivo. En el caso de los dirigidos por miARN la degradación del ARNm el modelo propuesto implica la interacción complementaria de el miARN con el ARNm y, a continuación, la contratación de los RISC, que en última instancia, conduce a la degradación de la meta ARNm. En la traducción modelo de represión que Se cree que tanto la interacción de los miARN y la RISC con el ARNm inhibe la progresión de la maquinaria ribosomal a lo largo del ARNm sin conducen a la degradación del ARNm. Este último modelo es porque en la hipótesis de la ejemplo de lin-4 la cantidad de lin-14 ARNm no disminuye, pero la proteína producto de la lin-14 ARNm se reduce.
Independientemente del mecanismo de acción es el efecto post-transcripcional regulación de la expresión génica. Hasta la fecha numerosos ejemplos de miARN mediada por los genes regulación han sido identificados en el desarrollo, la supervivencia celular y metabólica vías. Además, la participación de miARN procesos de la enfermedad en humanos han sido aclaradas o inferirse. En el CAE de cáncer se especuló que algunos miARN pueden clasificarse como supresores tumorales ya que la pérdida de su actividad se asocia con la progresión del cáncer. Un papel para miARN en neurodegenerativas las enfermedades también es sugerido por el ejemplo de la síndrome de X frágil. X Frágil El síndrome está causado por la expansión de una trinucleotide repetir en el gen FMR1 y el producto del gen FMR1, FMRP, es un ARN-proteína de unión que asocia con miARN.
BIBLIOGRAFIA
http://genmolecular.wordpress.com/regulacion-de-la-expresion-genica/
http://es.scribd.com/doc/14954421/regulacion-de-la-transcripicion-en-procariotas
http://themedicalbiochemistrypage.org/es/gene-regulation-sp.php


No hay comentarios:
Publicar un comentario